标题:细胞计数问题,需要实用的细胞计数仪器
计数细胞是了解细胞数量变化的基本方法,细胞数量变化是细胞生理功能表现的重要指标,准确的细胞数量变化提供准确的功能信息,错误的细胞数量变化提供错误的功能信息。所以细胞计数准确性决定细胞生理学研究的成功与失败。
机体内的细胞数量巨大无法整体计数,各组织器官内的细胞量仍然巨大也无法整体计数。细胞数量变化通常以细胞密度为指标,即单位体积内的细胞数量。计数细胞都是将组织细胞制成检测样本,转换成细胞悬液进行计数。一个检测样本里的细胞数量仍然巨大很难全部计数,通常是从样本里取少量细胞悬液进行计数,然后根据少量细胞悬液计数获得的细胞密度计算样本细胞数量。细胞悬液不同于溶液,细胞随时在沉降,细胞均匀分布是有条件的。计数取样具有随机性,计数得到的细胞密度不一定与样本细胞密度相同,要使二者相同,或非常接近,需要两个条件:一是取样有代表性,做到取样时细胞分布均匀,计数的样本细胞密度与总体样本密度相同;二是取样计数准确,做到取样体积准确,细胞计数准确。计数细胞的目的和任务是获得一个真实的样本细胞密度。通过细胞计数要获得一个真实的样本细胞密度,必须满足上述两个条件。
怎样实现细胞计数的两个条件呢?取样代表性问题。样本与总体总会有差异,样本细胞密度与总体细胞密度不可能完全相同,用样本细胞密度代表总体细胞密度是有条件的,差异不能太大。缩小差异的办法就是多次抽样,多个样本检测值均属可以接近总体样本细胞密度,多少个样本检测值能代表总体细胞密度?根据检验误差和可信度计算确定。取样准确性问题,实质上是一个工作态度问题,认真对待就可以解决。计数准确度达不到要求,主要是仪器性能有问题,结构原理不合理。
目前生物医学领域应用的细胞计数仪器都存在一些问题,细胞计数准确度都不高。细胞计数的目的是确定细胞悬液里的细胞密度,要求真实、准确。细胞密度是单位体积内的细胞数。细胞密度由计数样本体积和样本体积里细胞数两个测量参数构成。两个测量参数有一个计量不准确,细胞密度就不准确。根据这两个测量参数,看看目前常用的几种细胞计数仪器存在的问题。
血球计数板是计数细胞常用的器具,特点是简单、方便,检验样本量小。在显微镜下直接观察计数细胞,用计数板上的计数池定量计数样本体积。优点是计数细胞真实,数量准确;问题是计量体积不准确。计数池的容积很小,只有0.1微升。计数样品时,细胞悬液是从样品池与盖玻片之间的缝隙中进入,充满样品池和缝隙,缝隙部分的容积算不算计数池的容积?如果不算,实际样品容积大于计量容积:如果算,这一部分容积不完全恒定,缝隙大小受盖玻片和计数板表面光洁度影响,样本容积随缝隙大小变化。虽然这一部分容积很小,因为计数池容积也很小,相对所占比例不小。容积计量不准确是造成细胞密度不准确的主要因素。
流式细胞计数仪,以B.Dtc20-automated-cell-counter 为例,是一种基于库尔特原理的细胞计数仪。库尔特原理认为,悬浮在电解液中的颗粒随电解液通过小孔管时,取代相同体积电解液,导致小孔管内外两电极间电阻发生瞬时变化,产生电位脉冲,脉冲信号的大小和次数与颗粒的大小和数目成正比。这类细胞计数仪是根据细胞通过小孔引起电位变化计算细胞个数。仪器根据细胞体积大小设定脉冲信号上下限,在上下限之间的颗粒信号作为细胞记录,大于上限和小于下限的颗粒信号不作为细胞记录,与颗粒的颜色、形状、性质无关。这种计数方法不能区分细胞与非细胞颗粒,体积与细胞大小相同的非细胞颗粒也作为细胞记录下来。这类细胞计数仪的优点是,自动化程度高,快速方便,样本体积计量准确;主要问题是存在非细胞颗粒造成的假性细胞,细胞粘结造成细胞计数减少。所以这类细胞计数仪测量的细胞密度准确度或真实性不高。另一个问题是检测样本细胞数不能太少,而且计数的细胞样本不能回收再用,要求检测细胞浓度在细胞数/毫升 1 x 105–5 x 106范围内。
细胞自动计数分析仪(Cellometer ),是基于图像分析的细胞计数仪。计数原理类似与血球计数板,只是用用仪器摄像代替人眼观察计数。加20ml样本到计数仪计数板的样品室内,使细胞平铺为单层细胞,将计数板放入计数仪内,仪器摄像头自动观察和记录样品室内的细胞,通过电脑显示细胞图象,自动分析细胞图象、细胞大小和细胞浓度。该仪器的细胞计数方法不是记录样品室内的全部细胞,只是选取样品室内细胞分布的几个视野,分析视野内的细胞图像,确定细胞数。仪器设定一个视野面积近似于血球计数板一个白细胞计数单位的面积,样品室内液体深度是多少,等不等于血球儿计数板样品池深度0.1mm?视野面积与样品深度构成的体积等不等于血球计数板一个白细胞计数单位的体积?都不明确。所以计量样品的体积是一个问题;样品室内细胞分布不一定均匀,用一个视野内的细胞密度代表整体细胞密度也是一个问题。为什么不记录全部样品细胞?如果能够准确记录全部样品室内的细胞,加入的样品量(20ml)准确,得到的细胞密度自然准确。不能记录全部样品细胞,准确加入的样品量(20ml)不用,改用一个不确定样品体积计算密度,是该仪器设计的最大败笔。上面介绍的三种类型细胞计数方法,涵盖了现代生物医学领域细胞计数的基本技术和方法。三种类型细胞计数方法存在的主要问题是检测获得的细胞密度都不够准确,其次还存在两个问题:一是检验细胞样品不能回收再用,二是不能准确计数总量小于1000个细胞的样本。例如,极限稀释细胞克隆实验是研究细胞增殖、分化、凋亡的一种方法,需要准确计数几百个细胞,然后回收单个种植到培养孔内。上述三种细胞计数方法都做不到。
计数细胞获得一个准确的细胞密度,看起来很复杂,难度很大,实际上真正理解了细胞计数的目的和要求也不难解决。如果能够准确取一定量细胞样本,放到一个容器里,准确记录全部细胞,问题就解决了。怎样准确记录一个容器里的全部细胞?如果容器里有几百个细胞,无规律分布在底面上,用显微镜观察,全部准确计数出来不太可能,如果把容器底部分割成许多个方格,标出行列号,一个方格中只有几个细胞(不超过10个),很容易准确记录出来,既不会漏计,也不会重计,将各个方格里的细胞数汇总起来就是全部细胞数。实际上将细胞培养板底部标记上方格,用之替代血球计数板和Cellometer的细胞样品室,问题就解决了。谁来解决这个问题?网友回复:
以上想法有点过于简单,使用普通培养板后,如果需要计数,还是需要借助于其他专用细胞计数的方法和设备。
如果贴壁类细胞,形成接近于单层细胞,可以在培养皿/板底部划有规则的小格子,根据单个小格子的细胞数量,可以估数细胞数量;这个培养皿底部带格子的,市场上有成熟的产品。
如果是悬浮类细胞, 客户建议的方法不可行。
 此主题相关图片如下:细胞计数产品.jpg
此主题相关图片如下:细胞计数产品.jpg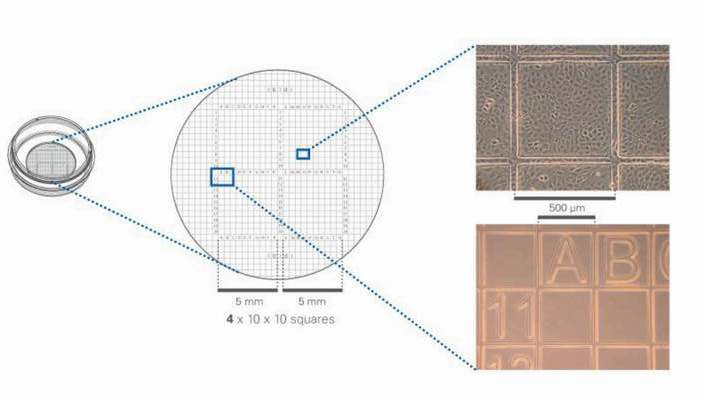
用户对6楼网友意见的答复,请大家关注并发表意见:
根据这位网友意见的几句话,可以判断出这位先生不是做细胞学实验的,不明白细胞计数要解决什么问题。认为只有接近单层的贴壁细胞,才能在培养皿小方格中计数,是不对的。贴壁细胞形成贴壁以后需要计数的情况很少,只有种植一天左右,尚未增殖的稀疏贴壁细胞,才可以形成单层,增值以后细胞分泌大量胶原蛋白把细胞包联在一起,很难分辨,甚至形成复层,一般需要染色处理才可以分辨清楚。如他演示的照片图,一个小方格里密密麻麻的细胞,能够准确计数出来吗?一般细胞计数是指细胞学实验前期的细胞计数工作,目的是掌握细胞密度和细胞数量,用于细胞实验,如种植,培养,观察其变化,而不是对实验结果形成的细胞计数。
这位网友认为悬浮细胞不能在培养板格子中计数也是不对的。细胞比重一般都大于1,悬浮只是暂时的,几分钟即可沉降到底面。做过细胞计数的人都知道。贴壁细胞实验一般也是先将贴壁生长的细胞“消化”,变成单个悬浮细胞以后,进行计数。肌肉细胞,上皮细胞都是贴壁细胞,一块肌肉,一片上皮组织,显微镜下无法计数细胞,必须将之消化变成悬浮细胞才能计数。
个人认为,应把该问题一分为二来讨论。首先,对于细胞数量巨大的总体,就目前的科技水平而言,只能通过统计学方法进行样本对总体的估计,虽无法做到与真实值的完全一致,但在确保各方法的取样、前处理过程得当的前提下,所得数据是具有统计学意义的,可以代表总体真实值,相差若干数量级的误差并无显著影响,过分追求庞大总体的真实值的讨论意义不大。在真假、死活细胞的判定上,目前计数器厂商也都有各自的鉴别方法,比如光学、电学等,以最大限度降低这类错误的发生。
其次,对于几百至几千个的少量细胞精确技术而言,不知能否将您建议的方法理解为“带整底布局计数网格的细胞培养板”,个人认为,在理论上该方法是可行的,但在技术层面和成本上可能还存在一些问题:
1. 培养板底部需要完整布局显微级别的精密计数网格,至少需要20X到40X的显微精度,不可能通过塑模一次成型,必然需要二次高精度工艺处理,对于培养板这种低值耗材来说,成本将翻数倍。另外站在生产厂家的角度,考虑到耗材的通用性,这种新型耗材的量产也可能受限。如果经费宽裕,该问题可以通过个性化定制来解决,利润可观的情况下肯定会有公司接受特殊需求。
2. 计数操作方法上,宏观与微观兼顾也有一定难度,低倍率的方法无法精确检测细胞,高精度光学和图像等分析技术(40X、100X)无法快速、大面积扫描整个培养板底部来精确计数所有细胞,人工计数在大批次实验中几乎又是不可能完成的。另外,底部表面积、沉降率、堆积重叠等问题仍然存在,其造成的计数错误对少量样品的计数影响显著。